Надпочечники представляют собой парный орган, расположенный на уровне XI- XII грудных позвонков забрюшинно в жировой клетчатке между листьями при почечной фасции над верхним полюсом почки.
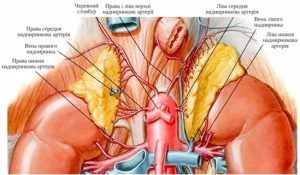
Анатомия надпочечников
Надпочечники состоят из двух морфофункциональных самостоятельных эндокринных желез — коркового и мозгового веществ, имеющих различное эмбриональное происхождение. Корковое вещество дифференцируется с интерреналовои ткани, которая является частью мезодермы, расположенной между двумя первичными почками. Мозговое вещество имеет общее происхождение с нервной системой, развиваясь с симпатобластов. Аналогичное происхождение имеет екстраадреналова хромафинной ткань, состоящая из параганглий и бифуркационных хро- мафинних телец.
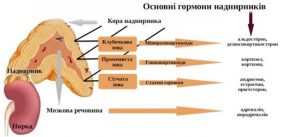
Гистологически в коре надпочечников, на долю которой приходится 80-90% ткани всего органа, выделяют три зоны. Непосредственно под капсулой находится клубочковая зона. В ней происходит синтез минералокортикоидов, основным представителем которых является альдостерон. К этой зоне примыкает пучковая зона, главными продуктами которой являются глюкокортикоидные гормоны. Во внутренней (сетчатой) зоне производится небольшое количество половых гормонов.
Гормоны коры надпочечников по основному типу клинического эффекта разделяют на три группы. К первой группе относятся глюкокортикоиды, основными представителями которых являются кортизол (гидрокортизон) и кортикостерон. Считают, что эти гормоны образуются в пучковой зоне. Во вторую группу входят минералокортикоиды, главными представителями которых являются альдостерон и дезоксикортикостерон. Они производятся в клубочковой зоне. Андрогены (17-кетостероиды и тестостерон), а также эстрогены (эстрадиол и эстрон), которые образуются в сетчатой зоне, составляют третью группу. Мозговое вещество надпочечников состоит из хромаффинных клеток. Различают два их вида, которые секретируют различные гормоны. Одни из них выделяют адреналин, другие — норадреналин.
При гиперфункции коры надпочечников развивается синдром Кушинга. У детей причиной этой болезни чаще всего является аденома надпочечников, а у взрослых повышение синтеза кортизола вызывает АКТГ, гиперсекреция которого связана в основном с опухолью гипофиза.
Главным действующим Минералокортикоиды является альдостерон. Его физиологическое значение заключается в том, что он выполняет две функции, такие, как: осморегуляция (регулирование количества воды и минеральных солей в крови) и регуляция кровяного давления. Основным механизмом, который регулирует секрецию альдостерона, является ренин-ангиотензин-(РААС).
Опухоли коркового слоя надпочечников
Опухоли коры надпочечников относят к числу наиболее тяжелых и сложных форм эндокринной хирургической патологии. Они характеризуются полиморфной клинической симптоматикой, обусловленной эффектом гормонов и продуктов опухолевого метаболизма.
Уточненных данных о частоте опухолей надпочечников не выявлено, так как не всегда вовремя эта патология диагностируется или диагностируется случайно. В структуре хирургической патологии надпочечников на долю опухолей коры приходится 35-40%. Частота опухолей надпочечников при аутопсии колеблется от 1,4 до 9%, а по данным КТ составляет от 0,4 до 4,4%. Наблюдается рост частоты заболеваемости среди детей до 5 лет и у больных старше 40-50 лет. Опухоли надпочечников чаще бывают у женщин (58,6%), чем у мужчин (41,4%). По эпидемиологическим исследованиям, риск возникновения опухолей надпочечников увеличивается у мужчин, если они курят, и у женщин в случае использования ими оральных контрацептивов
Этиология, патогенез, факторы риска
Опухоли надпочечников часто диагностируются случайно при проведении обследования по поводу других заболеваний (хронический гепатит и панкреатит, почечнокаменная болезнь и т.д.). Примерно у 1% людей в общей популяции проявляют опухоли надпочечника диаметром от нескольких миллиметров до 20 см и более, при этом без специфических клинических проявлений. Такие опухоли называют «инциденталомамы» надпочечников. Доброкачественные и злокачественные опухоли надпочечников могут быть как гормонально неактивными, так и проявлять гормональную активность — производить кортизол, альдостерон, андрогены, эстрогены.
Этиология опухолевого роста не установлена, хотя есть данные о хромосомные нарушения (генные мутации и делеции), активацию онкогенов, чинникив роста опухолей, можно считать вероятным механизмом молекулярного патогенеза.
В случае гормонально активных опухолей патогенез заболевания зависит от вида гормонов, секретирует опухоль. Большинство гормонально активных опухолей секретируют кортизол, реже — андрогены, эстрогены или альдостерон. Смешанные формы гормональной секреции встречаются почти в 75% случаев.
В зависимости от превалирующего гормональной секреции выделяют 4 основные синдромы гиперкортицизма:
- Синдром Иценко-Кушинга — гиперпродукция глюкокортикоидов.
- Синдром вирилизации (адреногенитальный синдром) — гиперпродукция андрогенов.
- Синдром феминизации — гиперпродукция эстрогенов.
- Гиперальдостеронизм — гиперпродукция минералокортикоидов.
Чаще всего встречается комбинация синдрома Иценко-Кушинга с вирильним синдромом.
Клиническая картина
Среди всех гормонально активных опухолей коры надпочечников распространенной является кортикостерома, которая в большом количестве синтезирует глюкокортикоиды (преимущественно кортизол) и минералокортикоиды, а также андрогены и частично эстрогены.
Кортикостерома (глюкостерома). Клиническая картина патологии обусловлена нарушением функции системы гипоталамус-гипофиз-надпочечники с выраженными признаками гиперкортицизма, который идентичен с синдромом Иценко-Кушинга.
Течение злокачественной гормонально активной опухоли надпочечника характеризуется быстрым нарастанием симптоматики и прогрессирующим ухудшением состояния больных, заметно отличает эту патологию от аналогичных по клинике заболеваний на почве доброкачественных аденом надпочечников (коры аденомы) и гиперпластических процессов в надпочечниках (болезнь Иценко-Кушинга).
Следует отметить определенную последовательность развития клинических синдромов при гормонально активных опухолях надпочечников. Ранними признаками опухолей с клиникой синдрома Иценко-Кушинга являются: нарушение половой функции, так называемый гетеросексуальный синдром (от 77 до 100%), расстройства менструального цикла (вплоть до стойкой аменореи и бесплодия), снижение либидо у женщин и потенции у мужчин, разной степени гирсутизм и облысение волосистой части головы, наличие сыпи на коже (acnae vulgaris) как у женщин, так и у мужчин, возможна лакторея (до 23% случаев).
У больных наблюдается выраженное диспластическое ожирение с преимущественным скоплением жира в области лица, плечевого пояса, передней брюшной стенки, с похудением конечностей за счет проксимальных амиотрофий; гиперемия и одутловатость лица (матронизм). Кожа становится сухой, тургор ее снижается, появляются типичные широкие, свиты, синюшно-багровые полосы растяжения ( «стрии»), которые локализуются на туловище, конечностях. Часто отмечают трофические процессы на коже голеней.
Синдром артериальной гипертензии иногда сопровождается развитием недостаточности кровообращения, сердечно-сосудистыми нарушениями.
К расстройству половой функции, увеличение массы тела, гипертонии, изменения кожного покрова и внешности впоследствии добавляются остеопороз, нарушение углеводного обмена (от нарушений толерантности к углеводам в стероидного СД). Клиническая картина дополняется выраженным астено-депрессивным синдромом, резкой слабостью, болями в пояснице, конечностях, головной болью.
Андростерома. Эта опухоль в значительном количестве секретирует андрогены — дегидроэпиандростерон (ДЭА) и дегидроэпиандростерон-сульфат (ДЭА-с), которые являются маркерами андрогенов надпочечников, а также андростендион, 11-ОН-андростендион, тестостерон, и обуславливает клиническую картину. У женщин опухоли диагностируются вдвое чаще, чем у мужчин. Часто эти опухоли злокачественные, поэтому даже после удаления могут рецидивировать. Бывают случаи прорастания капсулы злокачественной опухоли и ее распространения на ткань почки. Метастазирует злокачественная Андростерома в легкие, печень, почки.
Первыми клиническими признаками андрогенпродукуючои опухоли надпочечников является нарушение половой функции, а затем добавляются явления маскулинизации и дефеминизации. Четко вирильний синдром проявляется у женщин в виде гипоплазии молочных желез, изменения тембра голоса, появления акне на коже, выпадение волос на голове, гипертрофии клитора. Параллельно отмечается аменорея, бесплодие, часто — артериальная гипертония. У детей клиника сопровождается синдромом ложного преждевременного полового созревания по изосексуальным типу у мальчиков и гетеросексуальным — у девочек. Иногда клиника андростеромах сочетается с явлениями гиперкортицизма по типу синдрома Иценко-Кушинга.
Кортикоэстрома. Опухоль коры надпочечников с гиперпродукцией эстрогенов встречается редко. Описанная у мужчин и детей обоих полов, у взрослых женщин обнаруживают случайно, поскольку феминизации женщин клинически обнаружить невозможно. У женщин кортикоестрому диагностируют в случае ее сочетание с признаками синдрома Иценко-Кушинга. Клиника характеризуется развитием элементов феминизации мужчин: гинекомастия, изменение телосложения, прекращение роста бороды и усов, атрофия яичек, импотенция, олигоспермия, хотя размеры полового члена и предстательной железы остаются нормальными; иногда гипертония, увеличение массы тела, повышенная утомляемость, депрессия. Эти опухоли обычно большого размера и легко пальпируются. Иногда кортикоэстрома комбинируется с другими опухолями коры надпочечников.
Альдостерома. Опухоль клубочковой зоны. Клиника опухоли характеризуется артериальной гипертензией, тахикардией, мышечной слабостью (миастения). Миастения может быть выражена от легкой мышечной слабости к тяжелым Псевдопаралитическая состояний. Характерно снижение концентрационной функции почек, полиурия, полидипсия, никтурия, гипоизостенурия, пиелонефрит. Снижается толерантность к углеводам. Пациенты жалуются на головную боль, преимущественно в лобных долях, головокружение, одышку. Иногда отмечают боль в пояснице.
Диагностика
Основными в диагностике являются гормональные методы исследования: определение суточной экскреции с мочой 11-и 17-оксикортикостероиды (11- и 17-ОКС), 17-кетостероидов (17-КС), кортизола; в крови — уровень АКТГ, кортизола, ДЭА (ДЭА-с), тестостерона, 17-β-гидроксипрогестерона (17-β-ОН-Пр), альдостерона, ренина. К важным относятся также топические методы диагностики: УЗИ забрюшинного пространства, КТ и МРТ надпочечников и гипофиза.
Диагностика гиперкортицизма. Диагностику опухолей коры надпочечников проводят в три этапа: анализ анамнеза и клинической картины заболевания, проведения основных специальных гормональных и дополнительных лабораторных методов обследования; топическая диагностика. На первом этапе анализа жалоб пациента эндокринолог выясняет наличие характерных признаков гиперкортицизма. Если обнаруживают два и более признаков гиперкортицизма то назначают дополнительное гормональное и параклинические обследования.
В случае неполной клинической картины и незначительных изменениях гормональных показателей для подтверждения диагноза проводят дополнительные функциональные тесты с метопироном, дексаметазоном (малый и большой).
Методика проведения:
- Малый дексаметазоновый тест проводят в условиях стационара через сутки после госпитализации. Предполагается приема дексаметазона по 0,5 мг каждые 6 ч в течение 2-х суток. До и после назначения дексаметазона определяют содержание 17-ОКС и 117-КС в суточной моче и кортизола в крови.
- Большой дексаметазоновый тест проводят после малого, если при проведении последнего не происходит достаточного снижения экскреции 17-ОКС и 17-КС и кортизола в крови. При проведении большого теста дексаметазон назначают в дозе 2 мг каждые 6 ч в течение 2-х суток (8 мг / сут). До начала и после окончания теста исследуют содержание кортизола в крови и 17-ОКС и 17-КС в суточной моче.
- Пробу с метопироном проводят с целью дифференциальной диагностики болезни и синдрома Иценко-Кушинга. К началу проведения пробы определяют экскрецию 17-ОКС в суточной моче, затем пациент принимает метопироном в дозе 500 мг каждые 4 ч (всего 6 раз). После завершения пробы вновь определяют суточную экскрецию 17-ОКС.
Объяснение результатов.
Дексаметазон является блокатором секреции АКТГ. У здоровых лиц это приводит к подавлению секреции кортикостероидов надпочечниками и соответственно уменьшению экскреции их метаболитов.
- У больных с гипоталамическим синдромом и признаками гиперкортицизма при проведении малой пробы экскреция 17-ОКС и уровень кортизола в крови уменьшаются по сравнению с исходными показателями в 2 раза и более. Подобное не наблюдается при наличии эндогенного гиперкортицизма — болезни Иценко-Кушинга или синдрома Кушинга.
- У больных с болезнью Иценко-Кушинга при проведении большого пробы с дексаметазоном также под влиянием последнего подавляется секреция АКТГ, а соответственно и экскреция 17-ОКС. Снижается также уровень кортизола в крови, а при синдроме Кушинга (гормон-продуцирующая опухоль надпочечников) этого не происходит.
- метопироном подавляет активность 11β-гидроксилазы, что приводит к снижению секреции кортизола, альдостерона и кортикостерона. Уменьшение концентрации кортизола в крови по механизму «обратной связи» приводит к повышению секреции АКТГ с последующей стимуляцией образования КС. Однако в связи с блокадой 11β-гидроксилазы в большом количестве синтезируются только предшественники кортизола (17-гидрокси-11-дезоксикортикостерон, или S-вещество). При болезни Иценко-Кушинга после назначения метопироном секреция 17-ОКС с мочой повышается, а при синдроме Иценко-Кушинга она не меняется.
Примечания. У практически здоровых лиц экскреция 17-ОКС с мочой под влиянием метопироном также повышается до 28 мкмоль / сутки, а при болезни Иценко-Кушинга — более выражено (28 мкмоль / сутки).
При определении лишь 17-ОКС информативность проб не превышает 45%. Определение дополнительно и кортизола плазмы повышает информативность теста до 60-70%. Осложнений нет.
Дифференциальная диагностика. Дифференциальную диагностику опухолей коры надпочечников проводят с болезнью Иценко-Кушинга, гипоталамическим синдромом, ВДКН, склерополикистозом яичников, некоторым нозологическим формам врожденной патологии половых желез, пубертатной гинекомастией, феохромоцитомой и другими типами гипертензий.
Дифференциальную диагностику опухолей коры надпочечников прежде всего проводят с болезнью Иценко-Кушинга и АКТГ-эктопированной синдромом.
Опухоль мозгового слоя надпочечников.
Феохромоцитома (хромафинома) — опухоль с хромаффинных клеток диффузной нейроэндокринной системы, которая производит избыточное количество катехоламинов (адреналин, норадреналин, дофамин) и / или других биологически активных веществ. Локализуется опухоль в 90% случаев в надпочечниках и в 10% в других органах где есть хромаффинные клетки (преимущественно параганглии).
Чаще всего феохромоцитома возникает в 20-40 лет. Обычно феохромоцитомы доброкачественные. Около 10% феохромоцитом являются злокачественными. Вовремя не выявлено феохромоцитома может привести к тяжелым последствиям, вплоть до смертельного.
Симптомы Как правило, феохромоцитома проявляется внезапными приступами так называемыми катехоламинов кризисами. Продолжительность их составляет от 15 до 20 минут. Приступ может возникать с частотой несколько раз в день или реже, в тяжелых случаях в сутки может быть до 25 кризов. Заканчивается приступ обычно так же внезапно, как и появляется. В период между кризисами артериальное давление может снижаться до нормы или оставаться высоким.
Возможны пусковые факторы кризов:
- физические нагрузки;
- стрессы, нервное перенапряжение;
- изменение положения тела
- кишечная перистальтика;
- схватки или роды.
Употребление продуктов, богатых тирамин, может также провоцировать кризисов. Этого биогенного амина много в ферментированных продуктах, например:
- в зрелых сырах;
- в сушеном и копченом мясе;
- в авокадо, бананы, бобы;
- в маринованной рыбы;
- в квашеной капусте;
- в некоторых сортах пива.
Выброс гормонов могут спровоцировать наркотики (амфетамин, кокаин) и некоторые лекарственные средства:
- сосудосуживающие препараты (деконгестанты)
- ингибиторы МАО;
- блокаторы дофаминовых рецепторов
- ингибиторы обратного захвата серотонина;
- миорелаксанты;
- глюкокортикостероиды.
Катехоламиновые кризиса клинически проявляются:
- Высоким артериальным давлением;
- Головной болью;
- учащенное сердцебиение;
- выраженная потливость;
- Болью в сердце;
- Ощущение внутренней дрожи;
- страхом смерти;
- психического расстройства;
- снижением остроты зрения;
- Головокружение при изменении положения тела
- повышением сахара крови
- Нападение завершается обильным мочеиспусканием
Более редкими симптомами могут быть:
- Тревога, подавляющее ожидания беды;
- Боль в животе, запоры;
- Похудение.
Примерно в половине случаев артериальное давление у пациентов с феохромоцитомой повышенный постоянно.
Феохромоцитома может быть частью синдрома семейной множественной эндокринной неоплазии типа II (МЭН-II). МЭН-II включает в себя группу редких заболеваний, передающихся по наследству, при которых феохромоцитома сочетается с раком щитовидной железы и с опухолями во многих органах эндокринной (гормональной) системы.
В группе риска являются люди, у родственников которых оказывалась феохромоцитома в составе множественной эндокринной неоплазии II (МЭН-II), больные нейрофиброматоз — редким заболеванием, при котором на коже образуются множественные опухоли, а также развивается опухоль зрительного нерва. Кроме этого лица, страдающие болезнью Хиппеля — Линдау — редким генетическим заболеванием, характеризующимся образованием множественных кист в организме, которые могут становиться злокачественными. Риск возникновения феохромоцитомы у таких пациентов очень высок.
Диагностика Феохромоцитома часто обнаруживается случайно, когда пациент проходит обследование по другому поводу.
Врач-эндокринолог начинает диагностику с расспросы, выясняя наследственную предрасположенность, изучает историю болезни. Затем проводит измерения уровня артериального давления, подсчет частоты сердцебиения.
Анализы.
Далее обычно назначают лабораторные тесты для исследования уровня адреналина, норадреналина и их метаболитов:
- определение метанефрина и норметанефрина в моче, собранной за сутки
- определение уровня свободного метанефрина в плазме крови.
В настоящее время не используют измерения уровня катехоламинов (адреналина, норадреналина) мочи и уровня ванилилминдальной кислоты, так как в их показателях частые ложноположительные результаты.
При обнаружении повышенных уровней биологически активных веществ в анализах используют визуализационные методы, которые помогут выявить опухоль:
- компьютерную томографию (КТ) или магнитно резонансную томографию (МРТ) органов брюшной полости, надпочечников с контрастированием. Методы позволяют выявить опухоль размером более 5 мм.;
- сцинтиграфию, которую используют при подозрении на опухоль вне надпочечниками;
- позитронно-эмиссионную томографию (ПЭТ). Метод более чувствителен, чем сцинтиграфия, в плане выявления метастатических поражений.
При проведении исследования нужно учитывать возможность асимметричного накопления изотопа в нормальных надпочечниках. Если заболевание у нескольких членов семьи, или развилось до 40 лет, то проводят генетическое тестирование. Пациентам старше 50 лет генетическое исследование назначается редко.
Инциденталомы надпочечников. Больные с гормонально нефункционирующие опухолями приходят к врачу с жалобами на боль в животе, пояснице, подреберье, снижение аппетита, апатию. С между менее распространенных симптомов — потеря веса.
Лечение опухолей надпочечников
Все больные с опухолями надпочечников, которые имеют признаки гормональной активности или злокачественного роста (данные КТ, МРТ) и опухолями размером более 4 см требуют хирургического вмешательства — адреналэктомии. При наличии злокачественного роста также удаляют паранефральную клетчатку. При инкурабельным опухоли возможно проведение эмболизации сосудов, питающих опухоли, для уменьшения темпов роста последней и ее гормональной активности.
Операцию могут отложить в случае выраженной сердечно-сосудистой недостаточности, нарушениях мозгового или коронарного кровообращения, тяжелых нарушениях КОС, электролитно-водного обмена и биохимических и общих анализах мочи и крови к их устранению.
При опухолях надпочечников без признаков гормональной активности и размером до 4 см возможен контроль с контролем роста каждые 6 мес. Если наблюдается развитие опухоли, показано оперативное вмешательство. При злокачественных опухолях и опухолях размером более 6 см проводят открытую адреналэктомию. Если опухоли меньшего размера, рекомендуется проводить лапароскопическую адреналэктомию.
Результаты лечения
При лечении доброкачественных гормонально неактивных опухолей больные полностью излечиваются, работоспособность сохраняется, достигается обратное развитие стероидной кардио и энцефалопатии, стероидного диабета. Работоспособность больных будет зависеть от тяжести течения заболевания, количества и тяжести осложнений (больные могут работать только при определенных условиях производства и по определенному графику). При злокачественных опухолях после хирургического лечения прогноз зависит от распространенности процесса, агрессивности опухолевого роста.
