Надниркові залози являють собою парний орган, розташований на рівні XI– XII грудних хребців заочеревинно в жировій клітковині між листками приниркової фасції над верхнім полюсом нирки.
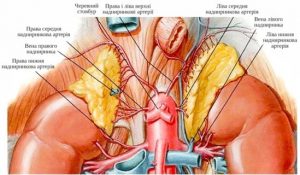
Анатомія надниркових залоз
Надниркові залози складаються з двох морфофункціональних самостійних ендокринних залоз – кіркової і мозкової речовин, що мають різне ембріональне походження. Кіркова речовина диференціюється з інтерреналової тканини, яка є частиною мезодерми, розташованої між двома первинними нирками. Мозкова речовина має спільне походження з нервовою системою, розвиваючись із симпатобластів. Аналогічне походження має екстраадреналова хромафінна тканина, що складається з параганглій і біфуркаційних хро- мафінних тілець.
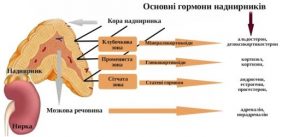
Гістологічно в корі надниркової залози, на частку якої припадає 80–90 % тканини всього органа, виділяють три зони. Безпосередньо під капсулою розташована клубочкова зона. У ній відбувається синтез мінералокортикоїдів, основним представником яких є альдостерон. До цієї зони прилягає пучкова зона, головними продуктами якої є глюкокортикоїдні гормони. У внутрішній (сітчастій) зоні виробляється невелика кількість статевих гормонів.
Гормони кори надниркових залоз за основним типом клінічного ефекту поділяють на три групи. До першої групи належать глюкокортикоїди, основними представниками яких є кортизол (гідрокортизон) і кортикостерон. Вважають, що ці гормони утворюються в пучковій зоні. До другої групи входять мінералокортикоїди, головними представниками яких є альдостерон і дезоксикортикостерон. Вони виробляються в клубочковой зоні. Андрогени (17-кетостероїди і тестостерон), а також естрогени (естрадіол та естрон), які утворюються в сітчастій зоні, становлять третю групу. Мозкова речовина надниркових залоз складається з хромафінних клітин. Розрізняють два їх види, які секретують різні гормони. Одні з них виділяють адреналін, інші – норадреналін.
При гіперфункції кори надниркових залоз розвивається синдром Кушинга. У дітей причиною цієї хвороби найчастіше є аденома надниркових залоз, а в дорослих підвищення синтезу кортизолу викликає АКТГ, гіперсекреція якого пов’язана в основному з пухлиною гіпофіза.
Головним діючим мінералокортикоїдом є альдостерон. Його фізіологічне значення полягає в тому, що він виконує дві функції, такі, як: осморегуляція (регулювання кількості води і мінеральних солей у крові) та регуляція кров’яного тиску. Основним механізмом, який регулює секрецію альдостерону, є ренін-ангіотензин-альдостеронова система (РААС).
Пухлини коркового шару наднирників
Пухлини кори надниркових залоз відносять до числа найбільш тяжких і складних форм ендокринної хірургічної патології. Вони характеризуються поліморфною клінічною симптоматикою, зумовленою ефектом гормонів та продуктів пухлинного метаболізму.
Уточнених даних стосовно частоти пухлин наднирників не виявлено, оскільки не завжди вчасно ця патологія діагностується або ж діагностується випадково. У структурі хірургічної патології наднирникових залоз на частку пухлин кори припадає 35-40%. Частота пухлин наднирників при аутопсії коливається від 1,4 до 9%, а за даними КТ становить від 0,4 до 4,4%. Спостерігається зростання частоти захворюваності серед дітей до 5 років та у хворих старших за 40-50 років. Пухлини наднирників частіше бувають у жінок (58,6%), ніж у чоловіків (41,4%). За епідеміологічними дослідженнями, ризик виникнення пухлин наднирників збільшується в чоловіків, якщо вони палять, та у жінок у разі використання ними оральних контрацептивів.
Етіологія, патогенез, чинники ризику
Пухлини наднирників часто діагностуються випадково під час проведення обстеження з приводу інших захворювань (хронічний гепатит і панкреатит, нирковокам’яна хвороба тощо). Приблизно в 1% людей у загальній популяції виявляють пухлини наднирника діаметром від декількох міліметрів до 20 см і більше, при цьому без специфічних клінічних проявів. Такі пухлини називають «інциденталомами» наднирників. Доброякісні та злоякісні пухлини наднирників можуть бути як гормонально неактивними, так і проявляти гормональну активність – виробляти кортизол, альдостерон, андрогени, естрогени.
Етіологія пухлинного росту не встановлена, хоча є дані про хромосомні порушення (генні мутації та делеції), активацію онкогенів, чинніків росту пухлин, що можна вважати вірогідним механізмом молекулярного патогенезу.
У випадку гормонально активних пухлин патогенез захворювання залежить від виду гормонів, які секретує пухлина. Більшість гормонально активних пухлин секретують кортизол, рідше – андрогени, естрогени чи альдостерон. Змішані форми гормональної секреції зустрічаються майже в 75% випадків.
Залежно від превалюючої гормональної секреції виділяють 4 основні синдроми гіперкортицизму:
- Синдром Іценка-Кушинга – гіперпродукція глюкокортикоїдів.
- Синдром вірилізації (адреногенітальний синдром) – гіперпродукція андрогенів.
- Синдром фемінізації – гіперпродукція естрогенів.
- Гіперальдостеронізм – гіперпродукція мінералокортикоїдів.
Найчастіше зустрічається комбінація синдрому Іценка-Кушинга з вірильним синдромом.
Клінічна картина
Серед усіх гормонально активних пухлин кори наднирників найпоширенішою є кортикостерома, яка в значній кількості синтезує глюкокортикоїди (переважно кортизол) і мінералокортикоїди, а також андрогени і частково естрогени.
Кортикостерома (глюкостерома). Клінічна картина патології зумовлена порушенням функції системи гіпоталамус-гіпофіз-надниркові залози з вираженими ознаками гіперкортицизму, який ідентичний із синдромом Іценка-Кушинга.
Перебіг злоякісної гормонально активної пухлини наднирника характеризується швидким наростанням симптоматики і прогресуючим погіршенням стану хворих, що помітно відрізняє цю патологію від аналогічних за клінікою захворювань на ґрунті доброякісних аденом наднирників (адренокортикальні аденоми) і гіперпластичних процесів у надниркових залозах (хвороба Іценка-Кушинга).
Слід зазначити визначену послідовність розвитку клінічних синдромів при гормонально активних пухлинах наднирників. Ранніми ознаками пухлин з клінікою синдрому Іценка-Кушинга є: порушення статевої функції, так званий гетеросексуальний синдром (від 77 до 100%), розлади менструального циклу (аж до стійкої аменореї і безплідності), зниження лібідо у жінок і потенції у чоловіків, різного ступеня гірсутизм й облисіння волосяної частини голови, наявність висипання на шкірі (acnae vulgaris) як у жінок, так і у чоловіків, можлива лакторея (до 23% випадків).
У хворих спостерігається виражене диспластичне ожиріння з переважним скупченням жиру в ділянці обличчя, плечового поясу, передньої черевної стінки, зі схудненням кінцівок за рахунок проксимальних аміотрофій; гіперемія й одутлість обличчя (матронізм). Шкіра стає сухою, тургор її знижується, з’являються типові широкі, звиті, синюшно-багряні смуги розтягання («стриї»), що локалізуються на тулубі, кінцівках. Часто відмічають трофічні процеси на шкірі гомілок.
Синдром артеріальної гіпертензії інколи супроводжується розвитком недостатності кровообігу, серцево-судинними порушеннями.
До розладу статевої функції, збільшення маси тіла, гіпертонії, зміни шкірного покриву і зовнішності згодом додаються остеопороз, розлад вуглеводного обміну (від порушень толерантності до вуглеводів до стероїдного ЦД). Клінічна картина доповнюється вираженим астено-депресивним синдромом, різкою слабкістю, болями в попереку, кінцівках, головним болем.
Андростерома. Ця пухлина в значній кількості секретує андрогени – дегідроепіандростерон (ДЕА) і дегідроепіандростерон-сульфат (ДЕА-с), які є маркерами андрогенів надниркових залоз, а також андростендіон, 11-ОН-андростендіон, тестостерон, що і зумовлює клінічну картину. У жінок пухлини діагностуються вдвічі частіше, ніж у чоловіків. Часто ці пухлини злоякісні, тож навіть після видалення можуть рецидивувати. Бувають випадки проростання капсули злоякісної пухлини та її розповсюдження на тканину нирки. Метастазує злоякісна андростерома в легені, печінку, нирки.
Першими клінічними ознаками андрогенпродукуючої пухлини наднирників є порушення статевої функції, а потім додаються явища маскулінізації й дефемінізації. Найчіткіше вірильний синдром виявляється у жінок у вигляді гіпоплазії молочних залоз, зміни тембру голосу, появи акне на шкірі, випадіння волосся на голові, гіпертрофії клітора. Паралельно відзначається аменорея, безплідність, часто – артеріальна гіпертонія. У дітей клініка супроводжується синдромом несправжнього передчасного статевого дозрівання за ізосексуальним типом у хлопчиків і гетеросексуальним – у дівчаток. Інколи клініка андростероми поєднується з явищами гіперкортицизму за типом синдрому Іценка-Кушинга.
Кортикоестрома. Пухлина кори наднирників з гіперпродукцією естрогенів зустрічається рідко. Описана у чоловіків і дітей обох статей, у дорослих жінок виявляють випадково, позаяк фемінізацію жінок клінічно виявити неможливо. У жінок кортикоестрому діагностують у разі її поєднання з ознаками синдрому Іценка-Кушинга. Клініка характеризується розвитком елементів фемінізації чоловіків: гінекомастія, зміна статури, припинення росту бороди і вусів, атрофія яєчок, імпотенція, олігоспермія, хоча розміри статевого члена і передміхурової залози залишаються нормальними; інколи гіпертонія, збільшення маси тіла, підвищена втомлюваність, депресія. Ці пухлини зазвичай великого розміру і легко пальпуються. Інколи кортикоестрома комбінується з іншими пухлинами кори надниркових залоз.
Альдостерома. Пухлина клубочкової зони. Клініка пухлини характеризується артеріальною гіпертензією, тахікардією, м’язовою слабкістю (міастенія). Міастенія може бути виражена від легкої м’язової слабкості до тяжких псевдопаралітичних станів. Характерним є зниження концентраційної функції нирок, поліурія, полідипсія, ніктурія, гіпоізостенурія, пієлонефрити. Знижується толерантність до вуглеводів. Пацієнти скаржаться на головний біль, переважно у лобних долях, запаморочення, задишку. Інколи відмічають біль у попереку.
Діагностика
Основними в діагностиці є гормональні методи дослідження: визначення добової екскреції із сечею 11- та 17-оксикортикостероїдів (11- та 17-ОКС ), 17-кетостероїдів (17-КС), кортизолу; у крові – рівень АКТГ, кортизолу, ДЕА (ДЕА-с), тестостерону, 17-β-гідроксипрогестерону (17-β-ОН-Пр), альдостерону, реніну. До важливих належать також топічні методи діагностики: УЗД зачеревного простору, КТ і МРТ надниркових залоз та гіпофіза.
Діагностика гіперкортицизму. Діагностику пухлин кори наднирників проводять у три етапи: аналіз анамнезу та клінічної картини захворювання; проведення основних спеціальних гормональних і додаткових лабораторних методів обстеження; топічна діагностика. На першому етапі аналізу скарг пацієнта ендокринолог з’ясовує наявність характерних ознак гіперкортицизму. Якщо виявляють дві й більше ознак гіперкортицизму то призначають додаткове гормональне і параклінічне обстеження.
У разі неповної клінічної картини і незначних змінах гормональних показників для підтвердження діагнозу проводять додаткові функціональні тести з метопіроном, дексаметазоном (малий і великий).
Методика проведення:
- Малий дексаметазоновий тест проводять в умовах стаціонару через добу після госпіталізації. Передбачається приймання дексаметазону по 0,5 мг кожні 6 год упродовж 2-х діб. До і після призначення дексаметазону визначають вміст 17-ОКС і 117-КС у добовій сечі та кортизолу в крові.
- Великий дексаметазоновий тест проводять після малого, якщо при проведенні останнього не відбувається достатнього зниження екскреції 17-ОКС і 17-КС та кортизолу в крові. При проведенні великого тесту дексаметазон призначають у дозі 2 мг кожні 6 год упродовж 2-х діб (8 мг/добу). До початку і після закінчення тесту досліджують вміст кортизолу в крові та 17-ОКС і 17-КС у добовій сечі.
- Пробу з метопіроном проводять з метою диференціальної діагностики хвороби і синдрому Іценка-Кушинга. До початку проведення проби визначають екскрецію 17-ОКС у добовій сечі, затим пацієнт приймає метопірон у дозі 500 мг кожні 4 год (загалом 6 разів). Після завершення проби знову визначають добову екскрецію 17-ОКС.
Пояснення результатів.
Дексаметазон є блокатором секреції АКТГ. У здорових осіб це призводить до пригнічення секреції кортикостероїдів наднирниками і відповідно до зменшення екскреції їх метаболітів.
- У хворих із гіпоталамічним синдромом й ознаками гіперкортицизму при проведенні малої проби екскреція 17-ОКС і рівень кортизолу в крові зменшуються порівняно з вихідними показниками у 2 рази і більше. Подібне не спостерігається за наявності ендогенного гіперкортицизму – хвороби Іценка-Кушинга чи синдрому Кушинга.
- У хворих із хворобою Іценка-Кушинга при проведенні великої проби з дексаметазоном також під впливом останнього пригнічується секреція АКТГ, а відповідно й екскреція 17-ОКС. Знижується також рівень кортизолу в крові, а при синдромі Кушинга (гормон-продукуюча пухлина наднирників) цього не відбувається.
- Метопірон пригнічує активність 11β-гідроксилази, що призводить до зниження секреції кортизолу, альдостерону і кортикостерону. Зменшення концентрації кортизолу в крові за механізмом «зворотного зв’язку» призводить до підвищення секреції АКТГ із наступною стимуляцією утворення КС. Однак у зв’язку з блокадою 11β-гідроксилази у великій кількості синтезуються тільки попередники кортизолу (17-гідрокси-11-дезоксикортикостерон, або S-речовина). При хворобі Іценка-Кушинга після призначення метопірону секреція 17-ОКС із сечею підвищується, а при синдромі Іценка-Кушинга вона не змінюється.
Примітки. У практично здорових осіб екскреція 17-ОКС із сечею під впливом метопірону також підвищується до 28 мкмоль/добу, а при хворобі Іценка-Кушинга – більш виражено (28 мкмоль/добу).
При визначенні лише 17-ОКС інформативність проб не перевищує 45%. Визначення додатково й кортизолу плазми підвищує інформативність тесту до 60-70%. Ускладнень немає.
Диференційна діагностика. Диференціальну діагностику пухлин кори надниркових залоз проводять з хворобою Іценка-Кушинга, гіпоталамічним синдромом, ВДКН, склерополікістозом яєчників, деякими нозологічними формами вродженої патології статевих залоз, пубертатною гінекомастією, феохромоцитомою та іншими типами гіпертензій.
Диференціальну діагностику пухлин кори наднирників передусім проводять із хворобою Іценка-Кушинга й АКТГ-ектопованим синдромом.
Пухлина мозкового шару надниркових залоз
Феохромоцитома (хромафінома) – пухлина з хромафінних клітин дифузної нейроендокринної системи, яка виробляє надлишкову кількість катехоламінів (адреналін, норадреналін, дофамін) та/або інших біологічно активних речовин. Локалізується пухлина у 90% випадків у наднирниках і у 10 % у інших органах де є хромафінні клітини ( переважно параганглії).
Найчастіше феохромоцитома виникає в 20-40 років. Зазвичай феохромоцитоми доброякісні. Близько 10 % феохромоцитом є злоякісними. Вчасно не виявлена феохромоцитома може призвести до важких наслідків, аж до смертельного.
Симптоми Як правило, феохромоцитома проявляється раптовими нападами так званими катехоламіновими кризами. Тривалість їх становить від 15 до 20 хвилин. Напад може виникати з частотою кілька разів на день або рідше, у важких випадках на добу може бути до 25 кризів. Закінчується напад зазвичай так же раптово, як і виникає. У період між кризами артеріальний тиск може знижуватися до норми або залишатися високим.
Можливі пускові фактори кризів:
- фізичні навантаження;
- стреси, нервове перенапруження;
- зміна положення тіла;
- кишкова перистальтика;
- перейми або пологи.
Вживання продуктів, багатих тираміном, може також провокувати криз. Цього біогенного аміну багато у ферментованих продуктах, наприклад:
- в зрілих сирах;
- в сушеному і копченому м’ясі;
- в авокадо, банани, боби;
- у маринованої риби;
- у квашеній капусті;
- у деяких сортах пива.
Викид гормонів можуть спровокувати наркотики (амфетамін, кокаїн) і деякі лікарські засоби:
- судинозвужувальні препарати (деконгестантів);
- інгібітори моноамінооксидази;
- блокатори дофамінових рецепторів;
- інгібітори зворотного захоплення серотоніну;
- міорелаксанти;
- глюкокортикостероїди.
Катехоламінові кризи клінічно проявляються:
- Високим артеріальним тиском;
- Головним болем;
- Прискореним серцебиттям;
- Вираженою пітливістю;
- Болем у серці;
- Відчуття внутрішнього тремтіння;
- Страхом смерті;
- Психічними розладами;
- Зниженням гостроти зору;
- Запамороченнями при зміні положення тіла;
- Підвищенням цукру крові;
- Напад завершується рясним сечовипусканням.
Більш рідкісними симптомами можуть бути:
- Тривога, гнітюче очікування біди;
- Біль у животі, закрепи;
- Схуднення.
Приблизно в половині випадків артеріальний тиск у пацієнтів з феохромоцитомою підвищений постійно.
Феохромоцитома може бути частиною синдрому сімейної множинної ендокринної неоплазії типу II (МЕН-II). МЕН-II включає в себе групу рідкісних захворювань, що передаються по спадку, при яких феохромоцитома поєднується з раком щитоподібної залози та з пухлинами в багатьох органах ендокринної (гормональної) системи.
В групі ризику є люди, у родичів яких виявлялася феохромоцитома у складі множинної ендокринної неоплазією II (МЕН-II), хворі на нейрофіброматоз – рідкісним захворюванням, при якому на шкірі утворюються множинні пухлини, а також розвивається пухлина зорового нерва. Крім цього особи, які страждають хворобою Хиппеля – Ліндау – рідкісним генетичним захворюванням, що характеризується утворенням множинних кіст в організмі, які можуть ставати злоякісними. Ризик виникнення феохромоцитоми у таких пацієнтів дуже високий.
Діагностика Феохромоцитома часто виявляється випадково, коли пацієнт проходить обстеження з іншого приводу. Лікар-ендокринолог починає діагностику з розпитування, з’ясовуючи спадкову схильність, вивчає історію захворювання. Потім проводить вимірювання рівня артеріального тиску, підрахунок частоти серцебиття.
Аналізи.
Далі зазвичай призначають лабораторні тести для дослідження рівня адреналіну, норадреналіну та їх метаболітів:
- визначення метанефрину і норметанефрина в сечі, зібраній за добу;
- визначення рівня вільного метанефрину в плазмі крові.
В даний час не використовують вимірювання рівня катехоламінів (адреналіну, норадреналіну) сечі і рівня ванилилминдальной кислоти, так як у їх показниках часті хибнопозитивні результати.
При виявленні підвищених рівнів біологічно активних речовин в аналізах використовують візуалізаційні методи, які допоможуть виявити пухлину:
- комп’ютерну томографію (КТ) чи магнітно резонансну томографію (МРТ) органів черевної порожнини, надниркових залоз з контрастуванням. Методи дозволяють виявити пухлину розміром більше 5 мм.;
- сцинтиграфію, яку використовують, якщо є підозра на пухлину поза наднирковими залозами;
- позитронно-емісійну томографію (ПЕТ). Метод більш чутливий, ніж сцинтиграфія, в плані виявлення метастатичних уражень.
При проведенні дослідження потрібно враховувати можливість асиметричного накопичення ізотопу в нормальних наднирниках. Якщо захворювання є у кількох членів сім’ї, або розвинулося до 40 років, то проводять генетичне тестування. Пацієнтам старше 50 років генетичне дослідження призначається рідко.
Інциденталоми наднирників. Хворі з гормонально не функціонуючими пухлинами приходять до лікаря зі скаргами на біль у животі, попереку, підребір’ї, зниження апетиту, апатію. З поміж менш розповсюджених симптомів – втрата ваги, інколи – гематурія, варикоцеле і порушення ритму дихання. Частина гормонально неактивних («німих») пухлин не мають визначеної клінічної симптоматики. При значних розмірах ці пухлини можуть бути доступними для пальпації, викликати порушення з боку розташованих поруч органів, судин і нервів. АТ зазвичай у нормі.
Лікування пухлин надниркових залоз
Усі хворі з пухлинами надниркових залоз, які мають ознаки гормональної активності чи злоякісного росту (дані КТ, МРТ), та пухлинами розміром понад 4 см потребують хірургічного втручання – адреналектомії. За наявності злоякісного росту також видаляють паранефральну клітковину. При інкурабельній пухлині можливе проведення емболізації судин, які постачають кров до пухлини, для зменшення темпів росту останньої та її гормональної активності.
Операцію можуть відкласти у разі вираженої серцево-судинної недостатності, порушеннях мозкового чи коронарного кровообігу, тяжких порушеннях КЛС, електролітно-водного обміну та біохімічних і загальних аналізах сечі й крові до їх усунення.
При пухлинах наднирників без ознак гормональної активності та розміром до 4 см можливий нагляд з контролем росту кожні 6 міс. Якщо спостерігається розвиток пухлини, показано оперативне втручання. При злоякісних пухлинах і пухлинах розміром понад 6 см проводять відкриту адреналектомію. Якщо пухлини меншого розміру, рекомендується проводити лапароскопічну адреналектомію.
Результати лікування
При лікуванні доброякісних гормонально неактивних пухлин хворі цілком виліковуються, працездатність зберігається, досягається зворотний розвиток стероїдної кардіо- та енцефалопатії, стероїдного діабету. Працездатність хворих буде залежати від тяжкості перебігу захворювання, кількості та тяжкості ускладнень (хворі можуть працювати лише за певних умов виробництва і за певним графіком). При злоякісних пухлинах після хірургічного лікування прогноз залежить від розповсюдженості процесу, агресивності пухлинного росту.
